Wer in die Geschichte blickt, sieht die Gegenwart in neuem Licht. Das gilt auch für die Virenforschung. Das Wissen über Viren explodiert in den letzten einhundert Jahren geradezu. Dennoch steht man noch am Anfang und lauert nervös auf Anzeichen für die nächste Pandemie.
Es war der 4. August 1890. 5.000 Forscher*innen aus 40 Ländern versammelten sich zum 10. Internationalen Medizinischen Kongress in Berlin in einem eigens für den Anlass umgebauten Zirkuszelt. Star in der Manege war Robert Koch. Er hatte sich den Beinamen Bazillenjäger weidlich verdient, weil er als Erster einen bakteriell verursachten Krankheitsprozess lückenlos nachverfolgen und den entsprechenden Erreger anzüchten konnte. In seiner Rede resümierte er die Erfolge des Fachs, um schließlich mit einer düsteren Mahnung den Schluss seines Vortrags einzuleiten. Man solle bedenken, dass man über die Erreger viel zu vieler Krankheiten noch gar nichts wisse: Keuchhusten, Gelbfieber, Masern, Scharlach, Pocken, um nur einige zu nennen. Hellsichtig animiert der zukünftige Nobelpreisträger von 1906 seine Kolleg*innen denn auch dazu, ihren Blick für einen neuen Bereich zu schärfen: Ich möchte mich der Meinung zuneigen, dass es sich bei den genannten Krankheiten gar nicht um Bakterien, sondern um organisierte Krankheitserreger handelt, welche ganz anderen Gruppen von Mikroorganismen angehören.“ Schließlich sollten es die holländischen Tabakbauern sein, die der Wissenschaft zu neuen Einsichten verhalfen. Eigentlich nicht die Bauern selbst, sondern deren
Pf lanzen. Die zeigten nämlich mosaikartig angeordnete Flecken auf ihren Blättern. Die Bauern der Provinzen Gelderland und Utrecht wenden sich 1879 in existenzieller Not an die Landwirtschaftliche Hochschule in Wageningen. Der deutsche Chemiker Adolf Eduard Mayer (1843–1942) nimmt sich als Direktor dieser Einrichtung persönlich der Sache an. Mayer presst Saft aus den kranken Blättern. Doch unter dem Mikroskop zeigen sich keinerlei Auffälligkeiten im Vergleich zum Extrakt aus gesunden Pflanzen. Als er gesunde Blätter mit der aus erkrankten Pflanzen gewonnenen Flüssigkeit impft, zeigen sich keine Veränderungen. Zuerst! Doch dann, nach knapp zwei Wochen, taucht auch hier das Mosaikmuster auf. Wie ist das möglich, wenn die infektiöse Lösung offensichtlich keine Erreger enthält? Mayer filtert die Flüssigkeit und staunt nicht schlecht, als selbst das Filtrat eine Infektion auszulösen vermag, und das sogar dann noch, wenn er es auf 60 Grad erhitzt. Handelt es sich vielleicht eher um ein Gift als um einen biologischen Erreger?
Mayers Nachfolger, Martinus Willem Beijerinck (1851–1931), hat eine neue Idee: Wenn das „Virus“, wie er es in seiner entsprechenden Publikation ohne weitere Einführung des Begriffs nennt, in einen Nährboden eindringt, muss es wasserlöslich und somit im Grunde flüssiger Natur sein. Besitzt es hingegen eine feste Natur, so würde es – wie klein es auch immer sein mochte – auf dem Nährboden liegen bleiben. Anderthalb Wochen gibt Beijerinck dem Virus Zeit, dann trägt er einen halben Millimeter Nährboden ab und gewinnt Proben aus den darunterliegenden Schichten. Als er mit diesem Material wiederum die Krankheit auslösen kann, steht für ihn fest, „dass das Virus als wirklich flüssig oder gelöst und nicht als corpusculär betrachtet werden muss“. Also definiert er das Virus als einen lebenden, flüssigen Ansteckungsstoff.
Mayers Nachfolger, Martinus Willem Beijerinck (1851–1931), hat eine neue Idee: Wenn das „Virus“, wie er es in seiner entsprechenden Publikation ohne weitere Einführung des Begriffs nennt, in einen Nährboden eindringt, muss es wasserlöslich und somit im Grunde flüssiger Natur sein. Besitzt es hingegen eine feste Natur, so würde es – wie klein es auch immer sein mochte – auf dem Nährboden liegen bleiben. Anderthalb Wochen gibt Beijerinck dem Virus Zeit, dann trägt er einen halben Millimeter Nährboden ab und gewinnt Proben aus den darunterliegenden Schichten. Als er mit diesem Material wiederum die Krankheit auslösen kann, steht für ihn fest, „dass das Virus als wirklich flüssig oder gelöst und nicht als corpusculär betrachtet werden muss“. Also definiert er das Virus als einen lebenden, flüssigen Ansteckungsstoff.

Typische Symptome der Tabakmosaikkrankheit
Das erste Bild vom Virus
Noch bis in die 1930er-Jahre sollte das Virus unsichtbar bleiben. Gleichwohl werden viele Krankheiten entdeckt, die auf ein Virus zurückgehen müssen, weil die aus Erkrankten gewonnenen Flüssigkeiten noch ansteckend sind, obwohl sie durch bakteriendichte Filter gedrückt wurden.
Auf diese Weise wird 1903 das Tollwutvirus isoliert. 1905 gelingt der Nachweis des Pockenvirus. 1907 kann der Erreger des Denguefiebers nach den Regeln der herrschenden mikrobiologischen Kunst dingfest gemacht werden. Das Virus der Kinderlähmung folgt 1909. Zwei Jahre später der Erreger der Kaninchenpest. 1911 dann das Masernvirus, im Jahr darauf das Herpes- und 1916 das Mumpsvirus. 1917 werden sogar Viren gefunden, die Bakterien auffressen und daher Bakteriophagen genannt werden. Und noch immer steht im Raum, dass es sich beim Virus um eine flüssige Substanz handeln könnte. Doch dann betraten die Brüder Ruska die Bühne der Wissenschaft. Ernst Ruska (1906–1988) erfand das Elektronenmikroskop und Helmut Ruska (1908–1973) erforschte, wie man mit diesem neuen Gerät biologische Strukturen sehen kann, auch wenn die Fachwelt sich diesbezüglich äußerst skeptisch zeigte. Denn im Inneren des „Übermikroskops“ sausten Elektronen mit halber Lichtgeschwindigkeit durchs Vakuum. Abgegeben von einer Glühkathode und beschleunigt durch eine Spannung von 80.000 Volt. Das war kein Ort, an dem organische Substanzen Bestand hatten. Aber Helmut Ruska ließ sich nicht beirren. Immerhin versprach die vom Elektronenmikroskop geleistete 30.000-fache Vergrößerung Einblicke in den Größenbereich deutlich unterhalb der Bakterien. Die messen 600–1.000 Nanometer, das neuartige Instrument seines Bruders hingegen konnte Strukturen bis zu zehn Nanometer erfassen.
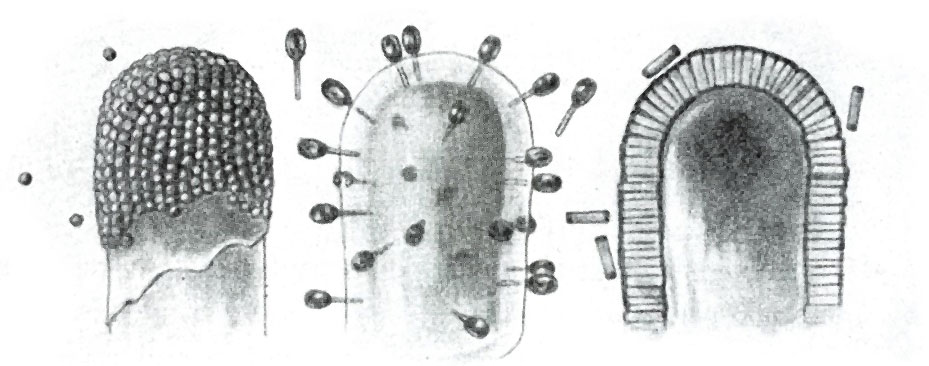
Verschiedenartige Phagen an der Membran einer Bakterienzelle (Quelle: Helmut Ruska. Virus. Potsdam 1950)
Der Durchbruch bahnte sich an, als Helmut Ruska seine Präparate mit einer „äußerst dünnen Haut“ aus Kollodium und einem Speziallack überzog. Außerdem experimentierte er mit einer Räucherung der Objekte durch das Platinmetall Osmium. Auf diese Weise gelang es ihm schließlich 1938, Tabakmosaikviren auf seinen Trägerfilm zu bannen, „das Virus optisch darzustellen und als kleine Körperchen in verschiedenartiger Zusammenlagerung zu erkennen“. Damit war endlich bewiesen, dass es sich bei Viren weder um ein Gift noch um eine flüssige Substanz handelt. Man hatte es mit Partikeln zu tun.
Wenn Viren Bakterien fressen
Helmut Ruska vermutete, dass Viren das Material der Wirtszelle nutzen, um sich fortzupf lanzen. Wenn diese Hypothese zutraf, bildeten diese winzigen Lebensformen eine Ausnahme von der allgemeinen Fortpflanzungsregel des Lebendigen. Das allein wäre ein guter Grund, den Viren die Lebendigkeit abzusprechen – was bis heute auch immer wieder getan wird. Viel spannender aber wäre es doch, eine ganz andere, einzigartige Vermehrungsstrategie kennenzulernen. Den besonderen Reiz dieser Forschungsaufgabe erfuhr der französische Mediziner und Biologe André Lwoff (1902–1994). Er arbeitete mit Bakteriophagen – also Viren, die Bakterien auffressen – und interessierte sich besonders für das Thema der sogenannten Lysogenie. Dieser Begriff beschrieb den merkwürdigen Umstand, dass von Viren befallene Bakterien nicht unbedingt sofort lysiert – zerstört – wurden. Sie trugen zwar das Programm zur Virenproduktion in sich, lebten aber erst einmal ganz normal weiter und teilten sich. Lwoff verfolgte die Hypothese, dass die Viren durch die Wirkung eines äußeren Faktors aktiv würden. Im Labor variierte er den pH-Wert, den Sauerstoffanteil und die Temperatur der Lösung, um die Population zu zwingen, Bakteriophagen freizusetzen. Doch ohne Erfolg. Erst als er die Bakterien dem UV-Licht aussetzte, wurden die Viren aktiv und lysierten die Bakterien. So ergab sich Mitte der 1950er-Jahre erstmals ein recht genaues Bild von der Vermehrungsstrategie der Bakteriophagen: Sie setzen sich am Bakterium fest und schleusen ihr genetisches Material in Form von Nukleinsäure in den Wirtsorganismus ein. Diese molekulare Information enthielt den Bauplan für den Bakteriophagen, war aber selbst kein Virus. Eher eine Vorstufe, weswegen die von Lwoff gefundene Bezeichnung Prophage sehr zutreffend scheint. Dieser Prophage agierte, „als sei er ein Gen des Bakteriums“, und ließ einen sogenannten Repressor produzieren, der die übrigen Phagengene blockierte. Im Bakterium herrschte nun ein molekulargenetischer Waffenstillstand, bis dann eines Tages die Gene, die für die Vermehrung des Phagen verantwortlich sind, durch äußere Einflüsse wie UV-Licht angeschaltet wurden. Die Proteinfabriken des Bakteriums, die Ribosomen, folgten nun nur noch den Anweisungen des Prophagen und produzierten Viren, solange sie noch konnten. In weniger als einer halben Stunde kollabierte der Wirt. Die Zellwand platzte, das Bakterium löste sich auf und mehr als hundert Viren strömten ins Freie, um weitere Wirte zu befallen. Seine Forschung führte Lwoff „zum Konzept des Virus“. Er stellte verschiedene, noch immer gültige Kriterien für die eigenwilligen Erreger auf. Demnach vermehren sich Viren nicht durch Teilung, sondern durch ihre Nukleinsäure, die entweder als DNA oder als RNA vorliegt. Anders als die übrigen Mikroorganismen können Viren weder wachsen noch sich teilen und haben keinen Stoffwechsel. Alle notwendige Energie für die Synthese der Viren wird dementsprechend nicht von ihnen selbst, sondern von der Wirtszelle geliefert.
Was Impfungen können
Das Verständnis der grundsätzlichen Vermehrungsstrategie ermöglichte auch die Entwicklung von Impfungen gegen krankheitserregende Viren. Eine Sternstunde der Virologie war hier sicherlich die Ausrottung des Poliovirus, das die sogenannte Kinderlähmung auslösen kann. Hierbei kamen die beiden Strategien einer Impfung gegen Viren zum Tragen: Jonas Edward Salk (1914–1995) entwickelte einen Totimpfstoff, indem er Polioviren mit Formalin inaktivierte. Albert Bruce Sabin (1906–1993) entschied sich hingegen für einen Lebendimpfstoff. Er wollte das Virus seines Impfstoffes genau auf den Grad abschwächen, bei dem es sich zwar noch im Darm vermehrt, zugleich aber keine Gefahr mehr für das Zentralnervensystem darstellt. Ein wahres Geduldsspiel, aber letztlich doch erfolgreich. Allerdings war die von Jonas Salk entwickelte Vakzine rascher einsatzbereit. Bis 1962 wurden in den USA 40 Millionen Dosen verimpft, und die Zahl der Erkrankungsfälle ging um spektakuläre 98 Prozent zurück. Sabins Immunisierungsmethode wurde später ebenfalls weltweit eingesetzt und als Schluckimpfung bekannt.
So wünschenswert die Bekämpfung von schwer verlaufenden Viruskrankheiten durch die Entwicklung von Impfungen auch ist, die Geschichte der Pandemien lässt an einem durchschlagenden Erfolg dieser Strategie zweifeln. Denn jede Impfung erhöht den Evolutionsdruck auf die Erreger. Zusätzlich engen die Segnungen der Zivilisation deren Entfaltungsräume ein. Doch die Viren reagieren einfallsreicher als all die seit Beginn der Industrialisierung ausgestorbenen Tier- und Pflanzenarten. So wie das Verdrängte in immer neuen Formen wiederkehrt, tun das auch die Viren. Sie sind viel länger auf der Erde heimisch als wir Menschen, wahrscheinlich sogar länger als jede andere Form des Lebens. Tatsächlich nehmen Epidemien weltweit immens zu. Das Johns-Hopkins-Zentrum für Gesundheitsschutz in Baltimore publizierte 2019 folgende besorgniserregende Zahl:

Literatur-Tipp
Matthias Eckoldt
Virus – Partikel,
Paranoia, Pandemien
Ecowin 2021, 256 S.
20 Euro
„Jährlich treten etwa 200 epidemische Ereignisse auf.“ Das heißt, etwa an jedem Arbeitstag des Jahres läuft irgendwo auf dieser Welt eine Epidemie an. Und manch eine hat pandemisches Potenzial, das sie bei geeigneten Bedingungen ausreizt. So steht zu befürchten, dass der Virologie auch in Zukunft die Forschungsobjekte nicht ausgehen werden.
Dr. Matthias Eckoldt












